Arbeitsgruppe Prof. Dr. Tüttenberg
Offene Stellen:
Wir freuen uns auch über Initiativbewerbungen für Bachelor-, Master- und Doktorarbeiten.
Leitung: Prof. Dr. Andrea Tüttenberg

Arbeitsgruppenleiterin, CEO/CMO und Co-Founder der ActiTrexx GmbH, Funktionsoberärztin Hautklinik und Poliklinik (derzeit beurlaubt)
+49 6131 17-2917, +49 6131 17-2545 (Sekreteriat)
+49 6131 17-472545Mitarbeiterinnen und Mitarbeiter

Fast-track Doktorantin
B.Sc. Biologie
+49 6131 17-6560 (Labor), +49 6131 17-5323 (Büro)
+49 6131 17-5505
Doktorantin
M.Sc. Biomedizinische Chemie
+49 6131 17-6560 (Labor) , +49 6131 17-5323 (Büro)
+49 6131 17-5505
PhD Candidate
M.Sc. Biomedizin
+49 6131 17-6560 (Labor), +496131 17-5323 (Büro)
+49 6131 17-5505Alumni
- Niklas Zimmer
- Germann Lysak
- Dr. Jonathan Schupp
- Lara Stein
- Dr. Franziska Krebs
- Dr. Susanne Hahn
Forschungsschwerpunkt
Das maligne Melanom gehört zu den bösartigen Tumoren weltweit mit zunehmender Inzidenz. In den letzten Jahren erlangten verschiedene immuntherapeutische Ansätze (anti-CTLA-4, anti-PD-1 Antikörper) sowie zielgerichtete Therapien (BRAF/MEK-Inhibitoren) eine zunehmende klinische Bedeutung. Die aktive Suppression der immunologischen Abwehr in Tumorpatienten durch ein inhibitorisches Tumormikromilieu verhindert jedoch immer wieder effiziente Antitumorantworten und limitiert somit immuntherapeutische Strategien in ihrer Wirksamkeit.
Ziel der Arbeitsgruppe ist die Charakterisierung neuer individueller regulatorischer Moleküle und Signalwege humaner Tumorzellen und ihrer Bedeutung für das Tumormikromilieu, um neue Biomarker sowie Zielstrukturen für immuntherapeutische Ansätze zu identifizieren. Hierbei werden sowohl molekularbiologisch als auch proteinchemisch die Immunantworten von Melanomzellen, regulatorischen T-Zellen und Makrophagen untersucht. Ein wichtiges Protein für die Entstehung eines inhibitorischen Tumormikromilieus konnte mit dem Oberflächenmarker GARP in der Vergangenheit identifiziert werden. Außerdem werden neue Therapieansätze für die Behandlung von schwarzen und weißem Hautkrebs entwickelt. Hier stehen uns Antikörper, nano-basierte Ansätze aber auch die Behandlung mit kaltem atmosphärischen Plasma (KAP) zur Verfügung. Des Weiteren nutzen wir unterschiedliche präklinische Modelle (z.B. Spheroide/Organoide, CAM assay, Mausmodelle), die es erlauben, die Funktion wichtiger Schlüsselmoleküle auch translational zu untersuchen.
Projekte
1. Bedeutung von GARP für das Tumormikromilieu
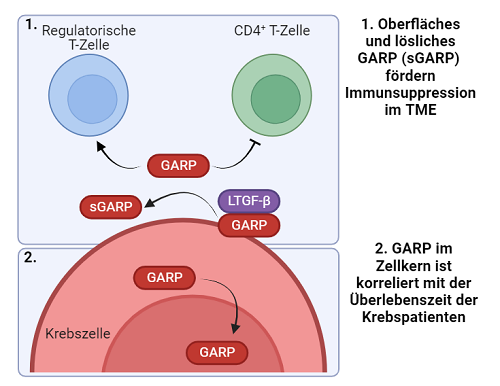
⦁ Bedeutung für die Differenzierung von Tumorstammzellen
Gefördert durch: Hiege Stiftung gegen Hautkrebs
⦁ Regulatorisches Schlüsselmolekül im Tumormikromilieu und neues Target zur
Tumorimmuntherapie
In der Vergangenheit gefördert von der Wilhelm-Sander-Stiftung
In der Vergangenheit konnten wir GARP als ein inhibitorisches Schlüsselmolekül identifizieren. So haben wir GARP, seine Regulation und seine Bedeutung für maligne Tumoren und Tumorstammzellen (Hiege-Stiftung) genauer beleuchtet und seine Bedeutung als Biomarker sowie als mögliches Target für eine (Antikörper-basierte) Tumortherapie (Wilhelm-Sander-Stiftung) untersucht.
Ziel dieses Projektes ist es, schrittweise zu analysieren, welche Funktionen GARP in den unterschiedlichen Zellarten des Tumormikromilieus, insbesondere in Tumorstammzellen, und Lokalisationen/Kompartimenten/Organellen, insbesondere nukleär, hat und wie dies zusammenhängt. Diese Arbeiten sollen ein tiefergehendes Verständnis hinsichtlich Tumorplastizität liefern. Daneben erhoffen wir uns Einblicke in die Regulation und Relevanz von GARP und daraus folgend Ansätze für eine molekularbiologische Diagnostik sowie einen therapeutischen Ansatz.
2. Modulation des Tumormikromilieus mittels Adressierung inhibitorischer (Immun-)Zellen über zeitlich programmierte und selbst-regulierende Liposome
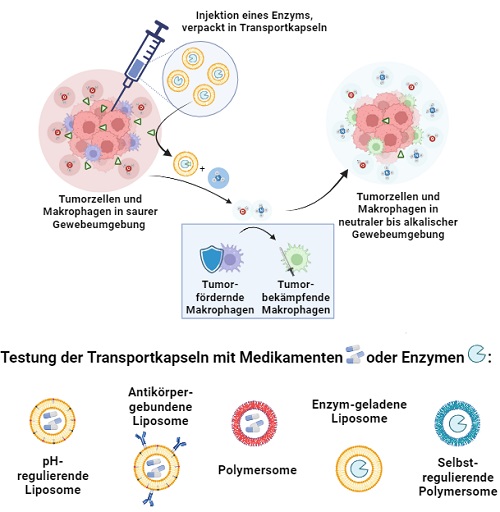
Gefördert durch: SFB 1066, TP B14
Die aktive Suppression der immunologischen Abwehr in Tumorpatienten durch ein inhibitorisches Tumormikromilieu verhindert effiziente Antitumorantworten und limitiert damit auch immuntherapeutische Strategien in ihrer Wirksamkeit. Thematischer Fokus dieses Projektes ist deshalb die Immunmodulation durch verschiedene therapeutische Ansätze im Tumorgewebe des malignen Melanoms (Primärtumor und Metastasen) in einem etablierten Melanommodell in der humanisierten Maus (immundefiziente HLA-A2 transgene NOD/Scidtg Mäuse) insbesondere über das Targeting inhibitorischer vermehrt im Tumormikromilieu vorkommender Zellpopulationen. Hierzu möchten wir vor allem Makrophagen, regulatorische T-Zellen (Treg) und Tumorzellen mit Hilfe smarter, programmierbarer Liposomen adressieren und die Modulation des Tumormikromilieus analysieren. Die entwickelten pH-responsiven Liposomen-Systeme werden auf die speziellen Anforderungen angepasst und kritisch um interne Programmierfähigkeiten erweitert: (i) Formulierung von Wirkstoffen zur Attenuierung der Immuntoleranz, wie z.B. „small molecules“ sowie therapeutischer siRNA und mRNA in Fortführung gemeinsamer Vorarbeiten, (ii) bevorzugte Aufnahme in Makrophagen mittels verzweigter hbPG-Stealth Polymere auf der Oberfläche der Liposomen, (iii) Funktionalisierung der Liposomen u.a. mit anti-GARP Fab-Fragmenten (bekannte GARP Expression auf aktivierten Treg, M2-Makrophagen und auf/in Tumorzellen), (iv) Programmierung von intern vor-programmierten pH-Zeitschaltern für die Freisetzung und (v) Implementation von selbstregulierenden pH-modulierenden Freisetzungssystemen über adaptive Liposome. Durch diese Kombination soll es gelingen, sowohl in das Tumormikromilieu als auch in die Signalsteuerung mittels sich selektiv anreichernden, intern programmierbarer und adaptiver Liposomen einzugreifen und diese Faktoren therapeutisch sinnvoll zu steuern.
3. Einfluss der Behandlung mit Kaltem Atmosphärischem Plasma (CAP) auf Immun- und
Tumorzellen als Therapieansatz bei Hauttumoren
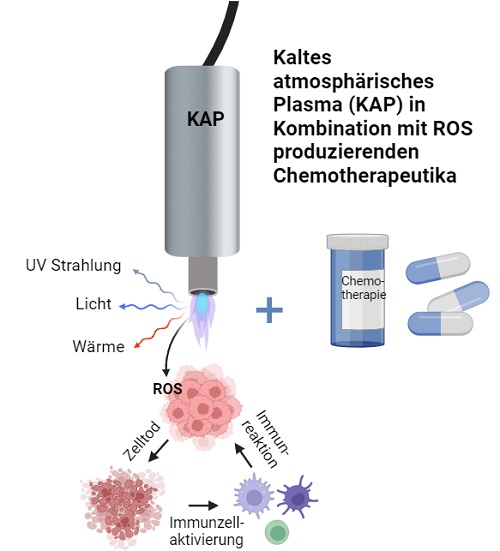
Gefördert durch: BOWA-electronic GmbH & Co. KG, 220906-22_902
Mit Energiezufuhr entsteht aus den Gasgemischen unserer Atemluft Plasma, der vierte hochenergetische Aggregatzustand. Das nicht thermisch ionisierte Gas wird auch als KAP (Kaltes atmosphärisches Plasma) bezeichnet. Es setzt sich aus UV-Strahlung, sichtbarem Licht, Wärmestrahlung, elektromagnetischen Feldern, Protonen sowie Elektronen und reaktiven Sauerstoff- und Stickstoffspezies (RONS) zusammen. Einige Arbeiten konnten zeigen, dass KAP sehr selektiv gegen Tumorzellen wirkt und körpereigene Zellen nicht schädigt. Welche molekularen Mechanismen dafür verantwortlich sind, ist noch nicht abschließend geklärt. Vorteil dieser Anwendung ist die (i) geringe Dauer einer Behandlung (60 Sekunden), (ii) dass sich keine Resistenzen entwickeln können und (iii) kein umliegendes, gesundes Gewebe geschädigt wird. Aufgrund dieser selektiven Eigenschaften von KAP hauptsächlich gegen maligne Zellen zu wirken, besteht großes Interesse das Plasma auch bei der Tumorbehandlung etablieren zu können.
In diesem Projekt wollen wir Effekte von KAP auf Zellen des Tumormikromilieus und somit mögliche therapeutische Ansatzpunkte zu identifizieren.
Methoden
- In vitro (Proteinbiochemie, zelluläre Immunologie, Metabolismus, konfokale Laserscanmikroskopie)
- Präklinische/translationale Modelle (Spheroide/Organoide, CAM Assay, Mausmodelle)
Ausgewählte Publikationen
1. Zimmer N, Trzeciak ER, Graefen B, Satoh K, Tuettenberg A. GARP as a Therapeutic Target for the Modulation of Regulatory T Cells in Cancer and Autoimmunity. Front Immunol. 2022 8;13:928450. doi: 10.3389/fimmu.2022.928450.
2. Trzeciak ER, Zimmer N, Kämmerer PW, Thiem D, Al-Nawas B, Tuettenberg A, Blatt S. GARP Regulates the Immune Capacity of a Human Autologous Platelet Concentrate. Biomedicines. 2022 5;10(12):3136. doi: 10.3390/biomedicines10123136.
3. Emily R. Trzeciak, Niklas Zimmer, Isabelle Gehringer, Lara Stein, Barbara Graefen, Jonathan Schupp, Achim Stephan, Stephan Rietz, Michael Prantner and Tuettenberg A. Oxidative Stress Differentially Influences the Survival and Metabolism of Cells in the Melanoma Microenvironment. Cells. 2022; doi.org/10.3390/cells11060930.
4. Satoh K, Kobayashi Y, Fujimaki K, Hayashi S, Ishida S, Sugiyama D, Sato T, Lim K, Miyamoto M, Kozuma S, Kadokura M, Wakita K, Hata M, Hirahara K, Amano M, Watanabe I, Okamoto A, Tuettenberg A, Jonuleit H, Tanemura A, Maruyama S, Agatsuma T, Wada T, Nishikawa H. Novel anti-GARP antibody DS-1055a augments anti-tumor immunity by depleting highly suppressive GARP+ regulatory T cells. Int Immunol. 2021 23;33(8):435-446. doi: 10.1093/intimm/dxab027.
5. Krebs FK, Trzeciak ER, Zimmer S, Özistanbullu D, Mitzel-Rink H, Meissner M, Grabbe S, Loquai C, Tuettenberg A. Immune signature as predictive marker for response to checkpoint inhibitor immunotherapy and overall survival in melanoma. Cancer Med. 2021 10(5):1562-1575. doi: 10.1002/cam4.3710.
6. Schupp J, Christians A, Zimmer N, Gleue L, Jonuleit H, Helm M, Tuettenberg A. In-Depth Immune-Oncology Studies of the Tumor Microenvironment in a Humanized Melanoma Mouse Model. Int J Mol Sci. 2021 Jan 20;22(3):1011. doi: 10.3390/ijms22031011.
7. Gleue L, Schupp J, Zimmer N, Becker E, Frey H, Tuettenberg A, Helm M. Stability of Alkyl Chain-Mediated Lipid Anchoring in Liposomal Membranes. Cells. 2020 Sep 29;9(10):2213. doi: 10.3390/cells9102213.
8. Zimmer N, Krebs FK, Zimmer S, Mitzel-Rink H, Kumm EJ, Jurk K, Grabbe S, Loquai C, Tuettenberg A. Platelet-Derived GARP Induces Peripheral Regulatory T Cells-Potential Impact on T Cell Suppression in Patients with Melanoma-Associated Thrombocytosis. Cancers (Basel). 2020 5;12(12):3653. doi: 10.3390/cancers12123653.
9. Schupp J, Krebs FK, Zimmer N, Trzeciak E, Schuppan D, Tuettenberg A. Targeting myeloid cells in the tumor sustaining microenvironment. Cell Immunol. 2019. 343:103713.
10. Zimmer N, Kim E, Sprang B, Leukel P, Khafaji F, Ringel F, Sommer C, Tuettenberg J, Tuettenberg A. GARP as an immune regulatory molecule in the tumormicroenvironment of glioblastoma multiforme. Int J Mol Sci. 2019. 20, 3676; doi:10.3390/ijms20153676.
11. Hahn SA, Neuhoff A, Landsberg J, Schupp J, Eberts D, Leukel P, Bros M, Weilbaecher M, Schuppan D, Grabbe S, Tueting T, Lennerz V, Sommer C, Jonuleit H, Tuettenberg A. A key role of GARP in the immune suppressive tumor microenvironment. Oncotarget. 2016. 7:42996-43009.
12. Hahn SA, Stahl HF, Becker C, Correll A, Schneider FJ, Tuettenberg A*, Jonuleit H*. Soluble GARP has potent anti-inflammatory and immunomodulatory impact on human CD4+ T cells. Blood. 2013. 122:1182-91. *shared senior authors
13. Zimmer, N., Trzeciak, E. R., Müller, A., Licht, P., Sprang, B., Leukel, P., Mailänder, V., Sommer, C., Ringel, F., Tuettenberg, J., Kim, E., & Tuettenberg, A. (2023). Nuclear Glycoprotein A Repetitions Predominant (GARP) Is a Common Trait of Glioblastoma Stem-like Cells and Correlates with Poor Survival in Glioblastoma Patients. Cancers, 15(24), 5711. doi: 10.3390/cancers15245711